為了避免移動醫療應用缺乏監管而存在的潛在風險造成傷害,美國食品藥品監督管理局(Food and Drug Administration;FDA)也已于2013年9月正式公告移動醫療應用(Mobile Medical Application Final Guidance)指導的最終版本,移動醫療在發展上也開始有初步的依循規范,更有助于移動醫療的發展。(你的app是否需要申請獲批,請查信息圖:你的移動醫療APP能否繞開FDA)
如同監管受MDDS(Medical Device Data System)規范的醫療設備一樣,FDA監管移動醫療應用的原則,也是劃分成3個類別,劃分方式是移動醫療應用的功能(functionality)若沒有正常運作時,造成病人安全風險的程度差異而定。
AliveCor的 總監 Michael Righter曾說,FDA實質上要求的就是類似軟件監管,一般好的軟件工程師會自然地做這些事情,像代碼審查、單元測試、系統級測試、變更監控等,這些方法通常需要有經驗的開發人員在軟件部署上嚴密操作。
FDA數字健康產品審批簡明指導

依照FDA的認定,需要被監管的移動醫療應用種類有3類,I 類醫療設備是可以連結并控制一個或多個醫療設備,或是顯示、儲存、分析、傳送特定病人的醫療設備資訊,如遠端顯示病人床邊監測器監測的資料、顯示腦波圖、控制血壓計袖帶充氣和放氣等。該類部分應用進入市場前可能只需一份510(k)申請,售前通知(premarket notification),與其他類App相比手續簡單。
II類醫療設備是可以藉由配件、顯示器、傳感器或是現行已受法規規范的醫學設備具備的功能,讓移動裝置可以轉變成受法規規范的移動醫療裝置,如將移動裝置接上血糖試紙,再使用裝置上的App檢驗血糖,讓該移動裝置成為血糖計。幾乎所有這類醫療設備都需自動提交510(k)申請,并進行售前通知。
III類醫療設備是可以執行特定病人的分析、提供特定病人的診斷或治療建議,這種用以分析醫學設備資料的獨立式運作軟體(Stand-alone software),FDA認為它是醫學設備的附屬品,所以它所受監管的分類會相同于搜集各種資料中最高風險設備的分類。該類醫療設備必須獲得FDA的售前批準(premarket approval)。且這期間需要臨床試驗,產品不同需要的時間也不等,幾年甚至更長,而且費用高昂。
申請III類的Global Kinetics公司開發的移動醫療設備Personal KinetiGraph,可監測和治療帕金森病,針對帕金森患者的活動提供全面的自動化報告,使神經科醫生和其他醫生可以更容易地識別運動癥狀的變化,幫助決策以優化治療。
三類醫療設備的差別是?以繃帶舉例,普通繃帶僅僅是覆蓋傷口無其他作用,則歸屬Ⅰ類;與手機連接,能夠通過應用查看傷口溫度,且不小心還可能傷口感染,對會診會有輕度風險,歸屬Ⅱ類;連接手機后,不只能顯示傷口相關信息,還能通過藥物算法給予患者反饋、指導等,歸為Ⅲ類。

確定你的產品后,然后結合合適的監管路徑和商業模式.如果你的模式是收費,那么你就可能會需要發表臨床結果及獲得FDA批準。

以下是動脈網就FDA對移動醫療(智能手機連接的醫療設備和獨立應用程序(App))的審批情況做的數據整理。2014年度,迄今為止,FDA已批準了31個數字健康產品。
FDA審批通過的移動醫療項目集中在4個類別
今年通過FDA 510(k)審核的移動醫療項目類別主要有app、軟件工具、移動醫療設備、移動醫療設備+app四個類別,除了軟件工具稍少以外,其余類別不相上下,軟件工具的項目細分領域主要是醫生工具——移動影像業。

醫生工具領域通過FDA審批的項目最多
從動脈網互聯網醫療研究院今年統計的FDA審批通過的移動醫療項目數據中,主要由有7個細分領域。其中,涉及健康數據記錄(軟硬件結合)的有9項;未結合其他醫療產品的健康數據記錄的有5項;醫生工具的有9項;單科疾病領域的有3項;其余大數據、疾病管理、云計算平臺各占1項。

2014迄今為止,FDA項目批準的時間走勢,從項目領域看到,5月份項目就只有兩個領域,醫生工具和健康數據記錄,看來,FDA對這兩個相對低風險的領域,“槍口稍抬高一寸”。

FDA審核項目熱點細分領域
在今年的審批項目中,動脈網互聯網醫療研究院統計了專注度較高的用途,主要有糖尿病、心臟病、運動追蹤、移動影像,涉及心臟的項目最多,其中包括測心率的移動醫療設備,用作治療及影像診斷的醫生工具,用于患者使用的心臟監測器。

哪些開發方正在樂衷于申請FDA?
2014年數字醫療產品獲批FDA的開發方情況體現了以下幾個趨勢:
1、成立時間不超過10年的新創公司占比最多,共有16家。這也說明,互聯網醫療創業公司正在加緊突破監管壁壘。
2、部分老牌醫療設備公司,正在進行努力做到突破和創新。例如Philips搭建的云計算平臺eCareCompanion、McKesson開發的心電圖監測app。
3、一些功能上與醫療嚴肅診療關聯度較遠,風險度非常小,更傾向于健身運動領域的產品也申請獲批FDA。比如就在幾日前,LG產品移動健康應用LG Smarthealth獲得美國FDA許可,用于追蹤活動、熱量等,事實上不需要FDA的許可,因為這些并沒有涉及到診斷、治療和預防任何疾病的目的。業內猜測,或許LG對此產品還有深入布局醫療領域的計劃。
4、相比患者DIY行為,醫生使用的移動醫療工具與診療往往密切相關,其安全性風險指數也較高,因而成為申請FDA的重點領域之一。
附:2014-YTD通過FDA審批的移動醫療項目匯總



















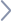















































































 京公網安備 11010502049343號
京公網安備 11010502049343號