“在醫藥研發領域,最為重要的就是數據。”甲骨文健康科學產品線北亞區總經理Jeff Lam表示。

”甲骨文健康科學產品線北亞區總經理Jeff Lam
在2015年席卷中國醫藥行業的“藥物臨床試驗數據核查風暴”中,CFDA發布了“史上最嚴的數據核查要求”,超過700個藥企的新藥申請因為試驗數據存在問題而被撤回或不予批準。
“臨床試驗需要摒棄掉主觀因素的影響,需要準確規范的臨床數據,才能判斷這種藥是不是真的有效。可以說,數據是其中非常重要的一環。目前CFDA的審核非常嚴格,一旦發現數據有問題,藥企可能兩年或者三年不能再申請新藥。”
作為全球最大數據庫軟件公司,甲骨文致力為醫藥研發、臨床試驗提供信息化支撐,希望幫助中國企業構建醫藥研發領域的新宏圖。
“不光是國內市場,中國藥企在拓展美國、日本、歐洲市場時,同樣會面對諸如美國FDA的嚴格要求。因為醫藥本身的門檻是比較高的。新藥如果要在歐美和中國一起上市,臨床試驗需要在歐洲、美國等很多國家都做,才能了解不同群體對藥品的不同反應。這要花費大量的時間和金錢來獲得臨床數據。而甲骨文希望幫助企業提高臨床實驗的數據質量,縮短研發時間,從而降低藥企的成本。”
目前甲骨文已經推出了多款產品和系列方案,來幫助藥企更好地進行臨床實驗。其中,包括“重新定義臨床實驗”的ClinicalOne,關注整個藥品安全生命周期的Safety360,以及端到端的數據管理、醫學數據采集的相關產品等。
“從整個臨床實驗的規劃、設計、實施,再到臨床試驗結束后的遞交申請,以及最后新產品獲批,所有這些階段,我們都有核心的系統來支撐。比如ClearTrial主要針對企業預算,CTMS是臨床實驗管理系統,IRT用于病人隨機性設計,Argus作為安全性平臺,用于臨床實驗過程中的不良反應風險監控。”甲骨文公司健康科學全球事業部產品策略全球副總裁James Streeter介紹。

甲骨文公司健康科學全球事業部產品策略全球副總裁James Streeter
此外,甲骨文還提供了針對醫院和醫生的醫療健康(Healthcare)產品,幫助醫生進行醫療分析、個性化醫療,以及提供電子病例存儲解決方案等。并把醫藥研發和醫療健康兩個領域的解決方案進行整合,實現以病人為中心的醫藥研究和醫療管理。
“對于甲骨文來講,我們還關注如何更好地利用這個真實世界的數據。比如從EHR電子病例中可以獲得非常多的數據,但大部分是非結構化的數據,因此如何能夠分析和利用好這些大數據,不管是從臨床的角度,還是從遞交給監管機構的角度來講,都是非常重要的。”
甲骨文在醫療大數據發掘、存儲和分析上擁有豐富的產品和技術,能從不同的渠道獲得不同的數據,從而實現更好地分析,幫助提升臨床試驗的水平。
“現在不僅僅要從數據管理的角度去看數據、使用數據,還要更多地從數據科學的角度,這樣可以尋找到一些新的治療解決方案。”
目前,包括恒瑞醫藥、華領醫藥、天壇生物在內的中國醫藥和生物公司都已經與甲骨文合作。
“中國藥企的實力越來越強,但要進一步走出國門,需要在全球收集臨床數據,進行更為完善的臨床實驗管理。而甲骨文在這方面有豐富的經驗,輝瑞、GSK、賽諾菲、默沙東等國際性大型藥企都是甲骨文產品的用戶,我們也愿意幫助中國企業走向世界。”
James Streeter最后總結道,“今年是甲骨文成立40周年,而在未來40年,我們也將進行不斷的產品和技術投入,為下一代的臨床實驗提供更多的想象空間,也希望幫助國內的臨床實驗獲得長足發展,在未來做得更好。”


















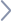















































































 京公網安備 11010502049343號
京公網安備 11010502049343號